
T细胞受体(T cell receptor, TCR)介导的抗原特异性识别是适应性免疫应答的核心,其精准区分"自我"与"非我"抗原的能力对肿瘤免疫监视至关重要。传统观点认为,经工程化改造的高亲和力TCR可增强抗肿瘤效果,但相关临床试验发现,这类改造后的TCR常常伴随着对自我抗原的交叉反应而引发脱靶毒性,这一问题严重阻碍了TCR-T等细胞疗法的临床转化应用。
浙大生仪学院尹巍巍团队与浙大医学院陈伟团队、中科院生物物理所娄继忠团队合作研究揭示:天然TCR通过柔性界面与抗原形成动态逆锁键(catch bond),在生理拉力的作用下,触发pMHC构象变化;该力学柔性赋予天然TCR选择性地调控辅受体CD8的构象及其与pMHC的结合能力,进而特异性地增强TCR对抗原的区分能力。然而,工程化高亲和力TCR因刚性结合界面破坏了这种力学柔性以及CD8的调控选择性,反而容易与非目标抗原稳定结合,产生脱靶毒性。基于这一研究,团队构建了力学-化学耦合调控的互作动力学特征与TCR功能关联映射模型,为设计高特异性TCR-T肿瘤免疫疗法提供了全新理论框架和量化评价工具,该研究成果发表在《Cell Research》。文章不仅阐明了辅受体CD8在天然TCR特异性识别中的关键作用和全新的调控机制,更为新一代高特异性TCR工程化设计提供了"力学"量化评价体系,为破解T细胞治疗中精准度与安全性难以兼顾的难题提供了关键理论支撑。
浙大生仪学院施佳未博士、浙大医学院良渚实验室博士后秦瑞、中科院生物物理所张宏博士、郑州大学武鹏博士为本文的共同一作,浙大医学院陈伟教授、生仪学院尹巍巍副教授、中科院生物物理所娄继忠研究员为共同通讯作者。本研究得到了中科大李小龙教授团队的大力支持,得到了国家自然科学基金交叉学部(T2394511)等项目的大力支持。
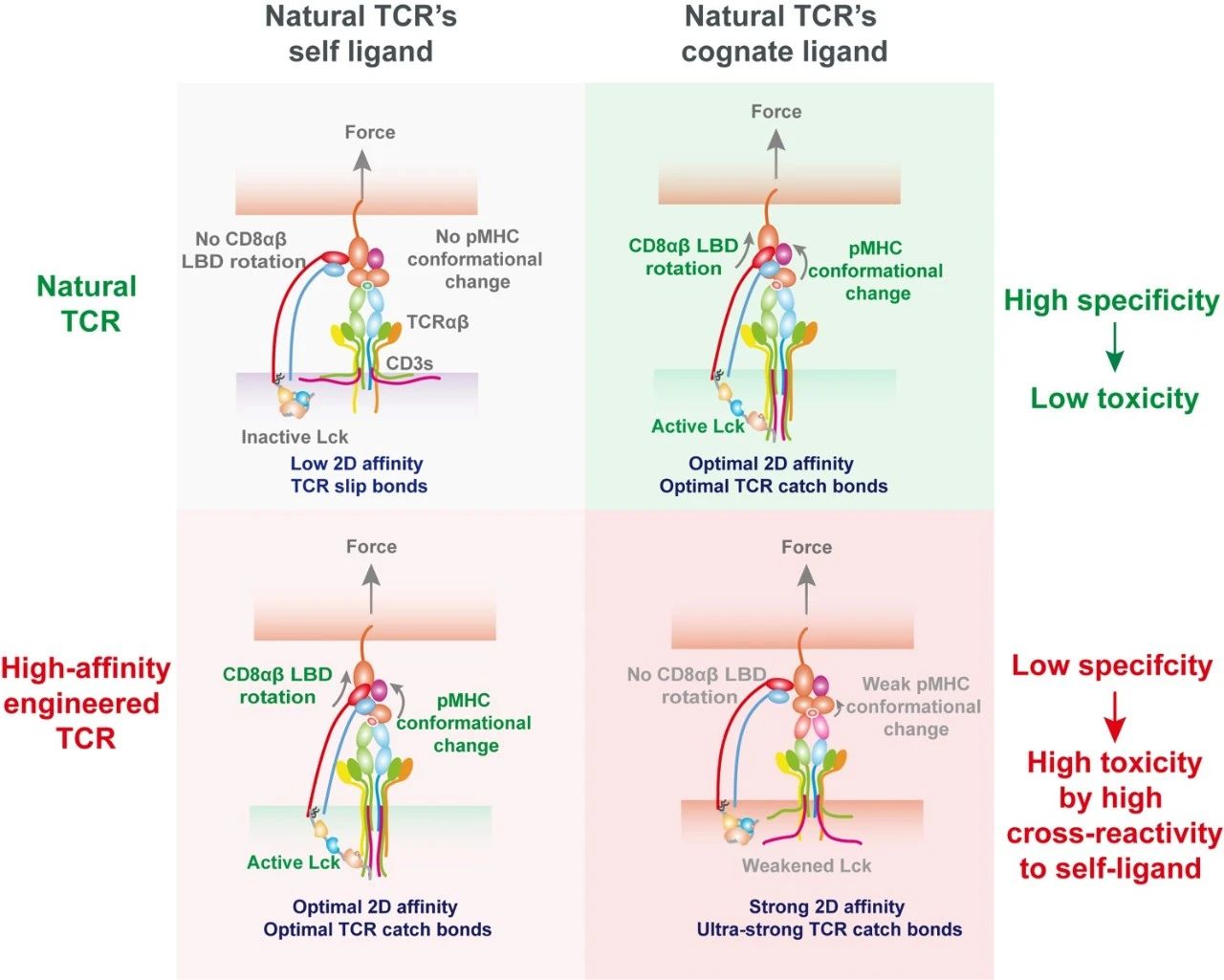
图1. 逆锁键非线性协同CD8塑造TCR抗原识别的特异性的模式图(天然存在的TCR对同源抗原具有高特异性,而高亲和力的工程化TCR则特异性较低)
来源:浙江大学生仪学院

